Principaux complexes d'histocompatibilité et antigènes présentant des cellules (avec chiffres)
Principaux complexes d’histocompatibilité et antigènes présentant des cellules!
Cellules présentant l'antigène (APC):
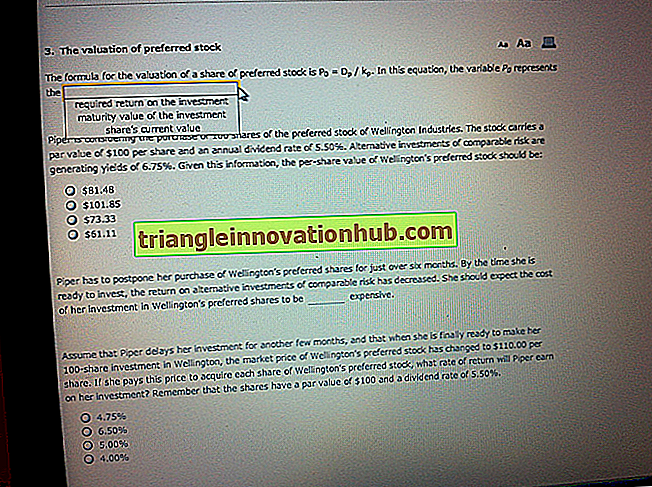
Les cellules qui traitent et présentent des antigènes étrangers sous une forme reconnaissable par les cellules T sont appelées cellules présentant l'antigène.
Pratiquement n'importe quelle cellule peut agir en tant que APC. Par conséquent, toutes les cellules doivent être appelées APC. Cependant, classiquement, les cellules (macrophages, monocytes, cellules B et cellules dendritiques) qui présentent des antigènes étrangers en association avec des molécules du CMH de classe II à des cellules T helper (CD4 + ) sont appelées cellules présentatrices d'antigène, car elles capturent un large éventail de substances. et les présenter aux cellules T auxiliaires.
Alors que les cellules qui présentent des antigènes étrangers avec les molécules du CMH de classe I aux cellules T cytotoxiques (CD8 + ) sont appelées cellules cibles. Les cellules infectées par le virus sont les cellules cibles importantes. Les cellules auto-altérées telles que les cellules cancéreuses et les cellules greffées d'un greffon sont également appelées cellules cibles.
Les cellules présentant l'antigène importantes sont:
je. Monocytes et macrophages
ii. Cellules Dendritiques
iii. Cellules B
Les macrophages sont largement distribués dans le corps et ont une capacité phagocytaire. Ils jouent donc un rôle primordial dans la présentation des antigènes de nombreux microbes pénétrant dans l'organisme. De plus, les macrophages possèdent des récepteurs Fc, à travers lesquels ils peuvent engloutir des antigènes revêtus d'anticorps et ensuite présenter ces antigènes aux lymphocytes T.
Selon leur emplacement dans le corps, les cellules dendritiques ont des noms différents. Dans l'épiderme de la peau, on les appelle les cellules de Langerhans et dans les organes lymphoïdes, on parle de cellules interdigitées. Ils sont dérivés de la moelle osseuse et ont la forme d'une araignée en raison de l'extension des processus cytoplasmiques, appelés dendrites.
Mais ils expriment d'abondantes molécules de CMH de classe II sur leur surface et présentent des antigènes aux cellules T auxiliaires. Ils peuvent migrer par le sang ou la lymphe. (Par exemple, quelques minutes après l'application d'un produit chimique sur la peau, les cellules de Langerhans transportent les antigènes chimiques vers les ganglions lymphatiques régionaux, présentent l'antigène aux cellules T auxiliaires et initient les réponses immunitaires.)
Les cellules B n'ont pas d'activité phagocytaire significative. Pourtant, ils capturent l'antigène par leur immunoglobuline de surface et internalisent l'antigène dans la cellule. L'antigène internalisé est ensuite présenté aux cellules T auxiliaires.
Principales protéines du complexe d'histocompatibilité:
Dans les années 1930, il a été constaté que l'acceptation ou le rejet d'une greffe de tissu d'un animal (donneur) à un autre animal (receveur) dépend d'un groupe particulier d'antigènes chez les deux animaux. Si le groupe antigénique est similaire entre le donneur et le receveur, le greffon est accepté; sinon la greffe a été rejetée.
Le nom d'antigène d'histocompatibilité a été inventé pour ces antigènes impliqués dans l'acceptation ou le rejet de la greffe. (Histocompatibilité = la capacité d'accepter des greffes de tissus d'un individu par un autre individu.) Plus tard, il a été constaté qu'une région particulière du chromosome jouait un rôle prédominant dans l'acceptation de la greffe ou le rejet de la greffe. Cette région du chromosome a été appelée histocompatibilité majeure (complexe MHO).
Le système immunitaire est sous le contrôle de gènes. Bon nombre des gènes qui régulent les fonctions immunitaires se trouvent dans une région chromosomique appelée complexe majeur d'histocompatibilité (MHC). Parmi tous les gènes impliqués dans l'histocompatibilité, les gènes du CMH jouent un rôle important, d'où le nom de complexe majeur d'histocompatibilité.
Le CMH a été trouvé à l'origine par son rôle dans la transplantation. Il est maintenant reconnu que le CMH joue également de nombreux autres rôles importants dans les réactions immunitaires, telles que la présentation de l'antigène aux lymphocytes et l'interaction entre les cellules lymphoïdes.
Il existe deux classes de gènes du CMH appelées gènes du CMH de classe 1 et gènes du CMH de classe II et les molécules protéiques codées par ces gènes sont appelées protéines du CMH de classe I et protéines du CMH de classe II, respectivement. Chaque protéine du CMH se lie à un peptide antigénique.
Toutes les cellules nucléées (à l'exception des spermatozoïdes) et les plaquettes chez l'homme expriment des molécules du CMH de classe I à leur surface. Cependant, les molécules du CMH de classe II sont principalement exprimées à la surface des monocytes, des macrophages, des cellules B et des cellules dendritiques (tableau 11.1). Les molécules du CMH de classe II sont également appelées antigènes la (antigènes de la réponse immunitaire).
Les structures des protéines du CMH de classe I et de classe II sont présentées à la figure 11.1. Les molécules de classe I et de classe II sont exprimées sous forme de protéines de surface liées à la membrane, dans lesquelles leurs caractéristiques polymorphes sont orientées vers l'extérieur de la cellule. Chaque protéine du CMH est composée de deux chaînes polypeptidiques liées de manière non covalente.

Structure de la protéine de classe I du CMH:
La molécule de classe I du CMH est composée de:
je. Une chaîne α de 44 000 daltons (une glycoprotéine) codée par le gène de classe I du chromosome 6, et
ii. Une microglobuline β 2 de 12 000 daltons codée par un gène du chromosome 15.
Le groupe carboxyle terminal de la chaîne a est ancré à la membrane cytoplasmique de la cellule. La partie extracellulaire d'une chaîne est pliée en trois domaines distincts appelés α 1, α 2 et α 3 .
La partie extracellulaire du domaine al est associée à un polypeptide plus petit appelé α 1 microglobuline. L'association de la β 2 microglobuline avec le domaine al est essentielle pour stabiliser la molécule de classe I et faciliter son transport à la surface de la cellule.
Le sillon de liaison du peptide antigène de la molécule de classe I (c'est-à-dire le site où le peptide antigène se lie à la molécule de classe I) est formé par la fente entre les domaines α 1 et α 2 . Le domaine a3 se lie à la molécule CDS du lymphocyte T CD8 + au cours de la présentation de l'antigène.
β 2 microglobuline:
La β 2 microglobuline est un peptide non glycosylé. Il est lié au domaine de la classe I une chaîne en dehors de la membrane plasmique. La β 2 microglobuline n'est pas ancrée à la membrane cellulaire. Bien que la β 2 microglobuline soit associée au complexe CMH de classe I-antigène, elle ne fait pas partie du site de liaison à l'antigène de la molécule de classe I. Pourtant, β 2 est nécessaire au traitement et à l'expression de la molécule de classe I. Si une cellule manque congénitalement de microglobuline P2, les molécules de classe I ne sont pas exprimées par cette cellule.
Structure de la protéine de classe II du CMH:
Les molécules du CMH de classe II sont des dimères formés par une chaîne un (31 000 daltons) et une chaîne β (27 000 daltons). Les terminaux carboxyle des deux chaînes sont ancrés à la membrane cellulaire. La chaîne α a deux domaines (α 1 et α 2 ) et la chaîne β a deux domaines (β 1 et β 2 ). Le sillon de liaison au peptide antigène est formé par les domaines α 1 et β 1 . La molécule CD4 sur la cellule T CD4 + est en contact avec le domaine β 2 .
Microorganismes extracellulaires et intracellulaires:
Après être entrés dans l'hôte, si les micro-organismes vivent à l'extérieur de la cellule hôte, ils sont appelés micro-organismes extracellulaires. Les microorganismes, qui vivent à l'intérieur de la cellule hôte, sont appelés microorganismes intracellulaires. Les mécanismes par lesquels les microbes extracellulaires et les microbes intracellulaires sont reconnus par le système immunitaire sont différents.
Par conséquent, les mécanismes effecteurs par lesquels les microbes extracellulaires et les microbes intracellulaires sont détruits sont également différents. En général, les microbes intracellulaires sont reconnus par la voie de classe I et sont tués par un mécanisme immunitaire à médiation cellulaire (CMI). Alors que les microbes extracellulaires sont reconnus par la voie de classe II et sont tués par le mécanisme humoral.
Reconnaissance des antigènes étrangers par les lymphocytes T:
Pour que les réponses immunitaires soient efficaces contre les antigènes étrangers, les cellules T doivent être activées contre les antigènes étrangers. L'activation des cellules T est au cœur des mécanismes effecteurs impliqués dans l'élimination des antigènes étrangers.
Avant de déclencher les réponses effectrices immunitaires, les cellules T doivent savoir que l'antigène étranger est entré dans l'hôte. Les cellules T ne reconnaissent pas les antigènes directement par eux-mêmes. (Tandis que les cellules B reconnaissent et lient directement les antigènes dans les fluides corporels par l’intermédiaire des immunoglobulines de surface situées sur les membranes des cellules B.) Les cellules T ont besoin d’autres cellules appelées cellules présentatrices d’antigène (APC) pour leur présenter les antigènes. (Par exemple, un policier capture un voleur et l’apporte à l’inspecteur de police pour qu’il poursuive la procédure.) Les APC présentent les antigènes des cellules T, appelés voies de classe I et voies de classe II. Après avoir reconnu l'antigène via l'APC, le lymphocyte T s'active et installe une réponse immunitaire contre l'antigène.
Traitement des antigènes et présentation des antigènes par les APC aux lymphocytes T:
Le système immunitaire acquis reconnaît principalement les antigènes protéiques présents sur des substances étrangères. Les APC clivent les antigènes protéiques étrangers en petits peptides, puis présentent ces antigènes peptidiques courts aux cellules T. Le processus de clivage des protéines étrangères en peptides par APC est appelé traitement d'antigène et le processus permettant de rendre ces peptides d'antigène accessibles à la reconnaissance par les cellules T est appelé présentation d'antigène.
Il existe deux manières de traiter et de présenter les antigènes par les APC, appelées voie de classe I et voie de classe II.
Voie de classe I (cytosolique):
Le virus vit à l'intérieur de la cellule hôte (et par conséquent appelé microbe intracellulaire) et utilise la machinerie de la cellule hôte pour produire des protéines virales. Les protéines virales synthétisées à l'intérieur de la cellule hôte sont présentées à la surface de la cellule hôte infectée par le biais d'une voie appelée voie de classe I (Figures 11.2 et 11.3).
Proteasome et LMP:
Les niveaux de protéines dans une cellule eucaryote sont régulés par la synthèse et la dégradation des protéines. Les protéines d'une cellule sont dégradées en peptides courts par un complexe protéase cytosolique appelé protéasome (Figure 11.3). Le protéasome est une grosse particule cylindrique constituée de quatre anneaux de sous-unités protéiques avec un canal central de 10 à 50A. une petite protéine appelée ubiquitine est liée à la protéine à dégrader par le protéasome. On pense que la dégradation de la protéine conjuguée à l'ubiquitine se produit dans le charme central du protéasome.

Fig. 11.2:
Diagramme schématique de la voie de classe I du traitement de l'antigène et de la présentation de l'antigène. Le génome viral dans le noyau de la cellule hôte infectée par le virus est transcrit et traduit en peptides viraux. Le peptide viral est complexé avec la molécule de classe I du CMH de la cellule hôte pour former le complexe peptidique viral du CMH de classe I. Le complexe est exprimé à la surface de la membrane cellulaire infectée par le virus et présenté aux cellules T CD8 +. Le récepteur des cellules T de CD8 + T ceil se lie au complexe peptidique du CMH de classe II-CMH et la liaison conduit à l'activation du lymphocyte T CD8 + contre le peptide viral.
LMP2, LMP7 (codées par les gènes du complexe MHC) et LMP 10 (codées par un gène ne figurant pas dans le complexe MHC) sont de petites protéines. Les protéines LMP2, LMP7 et LMPIO sont ajoutées au protéasome. L'ajout de LMP2, LMP7 et LMPIO au protéasome modifie l'activité protéolytique du protéasome, de sorte que les peptides pouvant se lier préférentiellement aux molécules du CMH de classe I sont générés par le protéasome.
Des niveaux accrus d'IFNγ induisent la production de LMP2, LMP7 et LMPIO.
Transporteur associé au traitement d'antigène (TAP):
Le transporteur associé au traitement de l'antigène est une protéine de RER transmembranaire. Le TAP est constitué de deux chaînes de protéines appelées TAP1 et TAP2, qui couvrent la membrane RER (Fig. 11.3). La TAP appartient à la famille des protéines de cassette se liant à l'ATP, qui interviennent dans le transport des acides aminés, des peptides, des sucres et des ions dépendant de l'ATP. Le TAP a plus d'affinité pour les peptides de 8 à 13 acides aminés, ce qui correspond à la longueur optimale du peptide qui convient pour la liaison à la molécule du CMH de classe I.
La TAP semble transporter des peptides avec des acides aminés hydrophobes ou basiques à extrémité carboxyle, qui sont les résidus d'ancrage préférés des molécules de MHC de classe I. Par conséquent, il apparaît que les peptides de transport de TAP sont appropriés pour se lier aux molécules du CMH de classe I.
Les gènes TAP1 et TAP2 sont situés dans la région de classe II du complexe MHC adjacent aux gènes LMP2 et LMP7.
Les virus infectent presque tous les types de cellules nucléées humaines. Toutes les cellules nucléées chez l'homme expriment des molécules de CMH de classe I sur leurs membranes cellulaires. Par conséquent, toute cellule nucléée chez l'homme est capable de présenter les antigènes viraux (si la cellule est infectée par le virus) sur leurs membranes cellulaires, ce qui conduit à la reconnaissance de la cellule infectée par le virus par les cellules T CD8 + . Par conséquent, le virus ne peut pas se cacher de l'attaque immunitaire et l'homme surmonte l'infection virale.


Figures 11.3A et B: (A) Schéma de principe de l'assemblage des chaînes polypeptidiques de classe IVIHC et du peptide viral et de l'expression du complexe peptidique viral MHC de classe I sur la membrane superficielle de la cellule présentatrice d'antigène.
Le génome viral dans la cellule hôte infectée par un virus est transcrit et traduit en un polypeptide viral. Le protéasome dégrade le polypeptide viral en peptides viraux courts. TAP transporte les peptides viraux courts dans le réticulum endoplasmique rugueux (RER). Dans le RER, le peptide viral se lie à la molécule de CMH de classe I pour former le complexe peptidique de CMH de classe I-CMH. Le complexe quitte le RER et rejoint le Golgi. Du complexe de Golgi, le complexe existe sous forme de vésicule exocytique.
La membrane de la vésicule exocytaire fusionne avec la membrane cellulaire de la cellule hôte infectée par le virus, ce qui aboutit à l’expression du complexe vers l’aspect externe de la cellule, où il peut être reconnu par le lymphocyte T CD8 +, et (8) assemblage du complexe peptidique viral MHC de classe I dans le RER.
Dans le RER, calnexin s’associe à la chaîne de classe MHC la. La microglobuline Pg s'associe à la chaîne de classe la et la calnexine est libérée de la chaîne α. Calreticulin et tapasin s'associent aux chaînes de classe La et Pg. Le peptide viral entrant dans le RER se lie à la molécule du CMH de classe I. Par la suite, la calréticuline et la tapasine se dissocient de la molécule de classe I
Chaque cellule a le potentiel de présenter un certain nombre de peptides antigéniques dérivés de n’importe quel virus, qui ont infecté la cellule. Cela augmente le risque que la cellule infectée soit reconnue et détruite par différents lymphocytes T cytotoxiques présentant une spécificité antigénique différente.
Classe II (voie endocytique):
Contrairement aux virus, la plupart des bactéries sont extracellulaires (les bactéries vivent et se multiplient en dehors de la cellule hôte). Les macrophages sont les cellules phagocytaires les plus importantes. Les macrophages engloutissent les bactéries dans l'environnement externe par un processus appelé endocytose (phagocytose et pinocytose). L'endosome contenant les bactéries fusionne avec le lysosome. Les lysosomes contiennent plus de 40 hydrolases dépendantes des acides, notamment des protéases, des nucléases, des glycosidases, des lipases, des phosphatases et des phosphatidases. Les enzymes lysosomales clivent les protéines bactériennes en un certain nombre de courts fragments peptidiques. Le court fragment de peptide antigénique bactérien est complexé à la molécule de CMH de classe II et présenté au récepteur des lymphocytes T du lymphocyte T CD4 + (figure 11.4).

Fig. 11.4: Diagramme schématique de la voie de classe II du traitement de l'antigène et de la présentation de l'antigène.
Les bactéries présentes dans l'environnement extracellulaire sont englouties par les macrophages. La membrane du phagosome fusionne avec les membranes lysosomales et les enzymes contenues dans les lysosomes divisent la bactérie en fragments peptidiques courts. La molécule du CMH de classe II se lie au peptide bactérien pour former le complexe peptidique du CMH de classe II.
Le complexe est exprimé à la surface du macrophage et présenté aux cellules T CD4 + . Le TCR des cellules T CD4 + se lie au complexe peptidique du CMH de classe II-bactérien à la surface du macrophage. Par conséquent, le lymphocyte T CD4 + est activé contre le peptide bactérien dans le complexe peptidique du CMH de classe II
Étapes séquentielles de la liaison d'une molécule de classe II avec le peptide antigène bactérien:
La molécule du CMH de classe II est constituée de deux chaînes polypeptidiques appelées chaîne et chaîne P (figure 11.1). Comme la molécule de CMH de classe I, la molécule de CMH de classe II est également synthétisée sur des polysomes le long du réticulum endoplasmique rugueux (RER). La molécule de classe n est destinée à se lier à des peptides dérivés de l'environnement extracellulaire de la cellule.
Par conséquent, la molécule de classe II ne devrait pas se lier aux peptides endogènes (tels que les peptides viraux), qui entrent également dans le RER. La liaison du peptide endogène à la molécule de classe II est empêchée par une chaîne polypeptidique appelée «chaîne invariante». La chaîne invariante s'associe au sillon de liaison à l'antigène de la molécule de CMH de classe II et empêche la liaison du peptide endogène à la molécule de classe II. La chaîne invariante semble également jouer un rôle important dans le repliement des chaînes polypeptidiques a et P de la molécule de classe II et leur sortie du complexe RER vers le complexe de Golgi (Fig. 11.5).
↓
Le complexe de chaîne Il-invariant de classe est transporté du complexe RER au complexe de Golgi et du complexe de Golgi au début de l'endosome. Le complexe passe d'un endosome précoce à un endosome tardif. Les enzymes protéolytiques dans les endosomes dégradent la chaîne invariante. Mais un court fragment peptidique appelé CLIP (peptide à chaîne invariante associée à la classe Il) reste dans le sillon de liaison au peptide de la molécule de classe II.
↓
À partir de l'endosome tardif, le complexe atteint le lysosome, qui contient les peptides antigènes bactériens. Dans le lysosome, le fragment CLIP est éliminé et le peptide antigène bactérien se lie au sillon peptidique de la molécule de classe II. L'élimination de CLIP et le chargement du peptide antigène dans la molécule de classe II sont catalysés par une autre protéine appelée protéine HLA-DM (codée par le gène HLA-DM).
↓
Ensuite, le lysosome contenant le complexe peptidique de classe Il-antigène se déplace vers la membrane cellulaire. La membrane du lysosome fusionne avec la membrane cellulaire, ce qui entraîne l'affichage du complexe peptidique de classe Il-antigène vers l'extérieur de la cellule.
↓
Le complexe peptidique Il-antigène de classe MHC situé à la surface des cellules est présenté au lymphocyte T auxiliaire (CD4 + ).

Fig. 11.5:
Diagramme schématique des étapes séquentielles de liaison de la molécule de CMH de classe II avec le peptide antigène bactérien. Les molécules α et β du CMH de classe II sont synthétisées dans le RER. Le sillon de liaison à l’antigène de la molécule de classe II est occupé par une chaîne polypeptidique appelée «chaîne invariante».
La molécule de classe II et la chaîne invariante sont transportées vers le complexe de Golgi, puis vers l'endosome précoce. Dans l'endosome tardif, la chaîne invariante est dégradée, mais un petit peptide appelé CLIP reste dans le sillon de liaison du peptide. Dans le lysosome, le fragment CLIP est retiré et le peptide antigénique bactérien est chargé dans le sillon de liaison à l'antigène pour former le complexe peptidique MHC de classe II-bactérien. La membrane lysosomale fusionne avec la membrane des macrophages et exprime le complexe peptidique du CMH de classe II-bactérien à la face externe du macrophage, où il peut être reconnu par les lymphocytes T CD4 +.
La voie de classe II est également appelée «voie exogène» du traitement de l'antigène car elle agit principalement sur les protéines capturées de l'extérieur de l'APC.
Au sein de la cellule, les molécules de classe I et de classe II empruntent différentes voies et sont complexes par rapport aux peptides antigéniques situés dans différents compartiments. Ce type de compartimentation aide les molécules de classe I et de classe II à acquérir des peptides antigènes dérivés de deux sources différentes (les sources intracellulaire et extra-cellulaire). Les molécules de classe I se lient à des peptides (tels que des peptides viraux) synthétisés dans la cellule hôte et la liaison se produit dans le RER (tableau 11.2). D'autre part, les molécules de classe II ne se lient pas aux peptides synthétisés dans la cellule hôte. Les molécules de classe II se lient à des peptides dérivés de l'environnement extracellulaire et la liaison a lieu dans les lysosomes contenant les peptides extracellulaires.
Il convient de noter que dans la voie de classe II, les peptides antigènes étrangers ne sont pas synthétisés dans les cellules hôtes. (En revanche, les peptides antigènes étrangers sont synthétisés dans les cellules hôtes dans la voie de classe I).
En cas de besoin, le traitement et la présentation de l'antigène par une cellule sont améliorés. Par exemple, l'IFNγ induit l'expression des molécules de classe I et de classe II sur les cellules hôtes, ce qui entraîne une présentation accrue de l'antigène aux cellules T.
En revanche, certains microbes peuvent réguler négativement (c’est-à-dire diminuer) l’expression des molécules du CMH. En raison de la régulation négative de l'expression de la molécule du CMH, le nombre d'expression des peptides antigènes diminue également. En conséquence, les chances d'expression d'antigènes microbiens diminuent également et le microbe échappe à sa mort. (Par exemple, le virus Herpes simplex produit certaines protéines qui bloquent la voie de classe I dans une cellule infectée par le virus Herpes simplex).
Différences dans les réponses immunitaires induites par les vaccins tués / peptidiques et les vaccins viraux vivants:
Les vaccins tués / peptidiques sont engloutis par les macrophages et traités selon la voie de classe II (parce que les vaccins tués / peptidiques sont engloutis de l'extérieur des macrophages et qu'ils ne se multiplient pas dans les macrophages). Ceci a pour résultat la présentation des antigènes de vaccin tués / peptidiques par les macrophages via la voie de classe II vers les lymphocytes T CD4 + . Le vaccin tué / peptidique se lie également aux immunoglobulines de surface des cellules B et active les cellules B.
Les cellules B activées reçoivent l'aide des cellules T CD4 + activées et sécrètent des anticorps contre l'antigène de vaccin tué / peptidique. Par conséquent, les anticorps jouent un rôle important dans la protection contre les microbes contre lesquels les vaccins tués / peptidiques ont été administrés. Les vaccins tués / peptidiques n'infectent aucune cellule et se multiplient dans la cellule hôte. Par conséquent, les antigènes de vaccin tués / peptidiques ne sont pas présentés avec les molécules du CMH de classe I et les réponses des cellules T CD8 + ne sont pas induites contre eux.
Considérant que, les vaccins viraux vivants infectent les cellules hôtes et se multiplient à l'intérieur des cellules hôtes. Par conséquent, les antigènes viraux associés aux molécules du CMH de classe I sont présentés aux lymphocytes T cytotoxiques. Cela se traduit par le développement de réponses immunitaires cytotoxiques contre les antigènes viraux. Pourtant, des anticorps sont également induits contre les vaccins viraux vivants. (Certains des virus vivants contenus dans le vaccin meurent ou sont tués par le mécanisme immunitaire. Les virus tués sont engloutis par les macrophages et présentés en association avec les molécules du CMH de classe II aux cellules T auxiliaires.
Par conséquent, les réponses des cellules T auxiliaires contre le virus sont induites. Certains des virus vivants ou morts du vaccin peuvent se lier directement à l’immunoglobuline de surface des cellules B et induire une réponse anticorps. Ainsi, des anticorps se forment également après la vaccination virale vivante.) Mais les anticorps ne pénètrent pas dans les cellules vivantes et n'attaquent pas les virus intracellulaires. Par conséquent, les réponses des cellules T cytotoxiques sont les principales réponses protectrices induites par les vaccins viraux vivants. Pourtant, les anticorps peuvent attaquer le virus:
une. dans l'intervalle entre le moment d'entrée du virus dans l'hôte et son entrée dans la cellule hôte, et
b. dans l'intervalle de temps entre la libération du virus d'une cellule infectée et son entrée ultérieure dans une autre cellule.
Activation des lymphocytes T:
Les lymphocytes T auxiliaires ou cytotoxiques sont activés lors de la liaison de leurs récepteurs de cellules T (TCR) aux complexes peptidiques molécule-antigène du CMH à la surface des APC.
Le peptide antigénique complexé à la molécule MHC possède deux sites d'interaction distincts:
je. Le site antigénique qui interagit avec le TCR s'appelle un épitope.
ii. L'autre site d'interaction qui interagit avec la molécule du CMH s'appelle l'agrétope. Le TCR sur les cellules T est un complexe de 8 protéines transmembranaires. Parmi celles-ci, les chaînes a et ß se lient au peptide antigène dans le complexe peptide CMH-antigène. Les 6 autres chaînes protéiques du TCR sont appelées complexe CDS.
L'activation des lymphocytes T nécessite deux liaisons entre le TCR du lymphocyte T et le complexe peptidique molécule-antigène du CMH sur l'APC.
Activation des cellules T helper:
L'activation des cellules T auxiliaires nécessite les deux liaisons suivantes:
je. Les chaînes α et β du TCR du lymphocyte T auxiliaire se lient au peptide antigène dans le complexe peptidique Il-antigène de classe MHC.
ii. La molécule CD4 sur le lymphocyte T auxiliaire se lie au domaine p2 de la molécule MHC de classe II.
Lors de ces deux liaisons, le complexe CD3 du TCR convertit la reconnaissance de l’antigène en signaux transmembranaires. Les signaux activent la cellule T auxiliaire.
Activation des cellules T cytotoxiques:
L'activation des cellules T cytotoxiques nécessite les deux liaisons suivantes:
je. Les chaînes α et β du TCR des cellules T cytotoxiques se lient au peptide antigène dans le complexe peptidique CMH de classe I-antigène sur APC.
ii. La molécule CD8 du lymphocyte T cytotoxique se lie au domaine α 3 de la molécule du CMH de classe I.
Lors de ces deux liaisons, le complexe CDS de lymphocytes T cytotoxiques envoie des signaux dans les lymphocytes T cytotoxiques, conduisant à l'activation des lymphocytes T cytotoxiques.
Restriction MHC des cellules T:
Nous devons comprendre la signification de «restriction des cellules T par le CMH». «Cellule T restreinte au CMH de classe I» signifie que le lymphocyte T ne reconnaît l'antigène que lorsque celui-ci est présenté avec la molécule du CMH de classe I. Par conséquent, les cellules T CD8 + sont des cellules T restreintes de classe I.
«Cellule T restreinte au CMH de classe II» signifie que le lymphocyte T reconnaît l'antigène avec la molécule du CMH de classe II uniquement. Les cellules T CD4 + sont donc des cellules T de classe II restreintes.
La restriction de classe I ou de classe II est un facteur important dans la détermination du type de réponse immunitaire induite par un antigène particulier. Les antigènes viraux sont complexés aux molécules de classe I et présentés aux cellules T CD8 + qui tuent les cellules hôtes infectées par le virus. Tandis que de nombreux antigènes bactériens sont complexés avec des molécules de classe II et reconnus par les cellules T auxiliaires CD4 +, ce qui entraîne une réponse anticorps.
Antigène de leucocytes humains HLa / Complexe:
Dans les années 1950, il a été découvert que les personnes qui avaient reçu plusieurs transfusions sanguines et les femmes enceintes plusieurs fois avaient des anticorps dans leur sérum, qui réagissaient avec les leucocytes d'autres humains. Les glycoprotéines membranaires des leucocytes, qui ont réagi avec ces anticorps, ont été appelées antigènes de leucocytes humains (HLA).
Maintenant, le terme HLA est utilisé comme synonyme des protéines du complexe majeur histocompatable humain (MHC).
Les gènes du complexe HLA codent les protéines du CMH. Chez l’homme, le complexe HLA est situé sur le bras court du chromosome 6, à environ 15 centimorgans (distance de la carte recombinante) à partir du centromère. Le complexe HLA s'étend sur environ 4000 kb et plus de 100 gènes sont situés dans la région HLA.
Chez la souris, les gènes du CMH sont présents sur le chromosome 17, il s’appelle complexe H-2.
La région du complexe du gène HLA humain est décrite comme ayant deux régions, la région de classe I et la région de classe II (figure 11.6).

Gènes de classe I:
La région du gène HLA de classe I se situe à l'extrémité télomérique du complexe HLA. Il existe de nombreux gènes dans la région de classe I.
je. Il existe trois gènes de classe I appelés HLA-A, HLA-B et HLA-C et les protéines codées par ces protéines (protéines HLA-A, HLA-B et HLA-C, respectivement) sont appelées protéines d'histocompatibilité MHC classe I .
ii. Les gènes des cytokines, du facteur de nécrose tumorale a (TNFa) et du facteur de nécrose tumorale P (TNPP) se situent à proximité du locus HLA-B.
iii. Un autre gène appelé gène HLA-G est également dans la région de classe I.
Gènes de classe II:
La région du gène HLA Classe II comprend également de nombreux gènes.
je. Il existe trois gènes de classe II, appelés HLA-DP, HLA-DQ et HLA-DR. Les protéines codées par ces gènes (protéines HLA-DP, HLA-DQ et HLA-DR, respectivement) sont appelées protéines MHC de classe II. .
ii. Gène pour 'transporteur du peptide antigénique-l' (TAP-1).
iii. Gène pour 'transporteur du peptide antigénique-2' (TAP-2).
iv. Gène pour 'protéine de faible poids moléculaire 2' (LMP2).
v. Gène pour 'protéine de faible poids moléculaire 7' (LMP7).
vi. Le locus du gène HLA-DM est également dans la région de classe II.
vii. Outre ces gènes, il existe d'autres gènes dont les fonctions sont inconnues.
Chez un individu, le complexe HLA d'un chromosome comprend trois loci de classe I (HLA-A, HLA-B et HLA-C) et trois loci de classe II (HLA-DP, HLA-DQ et HLA-DR). Un individu a une paire de chromosomes, l'un du père et l'autre de la mère. Chaque individu a donc six loci de classe I (deux HLA-A, deux HLA-B et deux Hoci-HLA-C) et six loci de classe II (deux HLA-DP, deux HLA-DR et deux HLA-DQ).
Le polymorphisme est le terme appliqué à un locus de gène portant deux allèles ou plus par différents membres de la population (en revanche, le locus de gène monomorphe porte le même allèle dans tous les membres de la population.) Il existe de nombreuses versions alternatives de chaque gène du CMH qui donnent protéines avec des séquences légèrement différentes (c.-à-d. qu'il existe plusieurs allèles différents de chaque gène).
Le nombre d'allèles reconnus de chaque locus (selon le groupe d'informatique HLA de l'Anthony Nolan Bone Orow Mrow Trust) est le suivant:
Allèles HLA-A-124
Allèles HLA-B-258
Allèles HLA-DR-265
Allèles HLA-DQ-58
Allèles HLA-DP-99
La diversité de ce type est appelée polymorphisme allélique. Incidemment, les gènes HLA constituent le système génétique le plus polymorphe connu. Presque tout le polymorphisme parmi les allèles HLA implique des séquences d'acides aminés situées dans et autour du sillon de liaison au peptide antigène des protéines du CMH.
Chez un individu, tous les gènes HLA sont exprimés de manière codominante. Il existe donc six protéines de classe I (deux protéines HLA-A, deux protéines HLA-B et deux protéines HLA-C) et six protéines de classe II (deux protéines HLA-DP, deux protéines HLA-DQ et deux protéines HLA-DR). surface de la cellule.
Lorsque les deux chromosomes d'un individu codent la même protéine HLA, l'individu est dit homozygote vis-à-vis du gène HLA particulier (par exemple, les deux chromosomes codent HLA-A6). Si les gènes de deux chromosomes chez un individu codent des protéines HLA différentes, l'individu est dit hétérozygote par rapport au gène HLA particulier (par exemple, un chromosome code HLA-6 et un autre code chromosome HLA-8).
Les gènes TAP-1 et TAP-2 codent pour les protéines impliquées dans la voie endogène du traitement de l'antigène.
Gènes MHC non classiques:
Les protéines codées par les gènes non classiques sont structurellement similaires aux protéines de classe I ou de classe II, mais ont des rôles différents dans l'immunité (par exemple, la protéine HLA-G contrôle les réponses immunitaires à l'interface fœto-maternelle).
Ainsi, le complexe de gènes HLA possède de nombreux gènes étroitement liés, dont la plupart sont impliqués dans le traitement et la présentation de l'antigène. Cependant, peu d'autres gènes (comme les gènes des facteurs de nécrose tumorale α et β du complément C2, C4, B et F) de cette région ont d'autres fonctions. L'importance de leur association avec les gènes du CMH n'est pas connue.
Troisième voie de présentation de l'antigène:
Habituellement, les protéines / glycoprotéines sont capables d’induire des réponses immunitaires acquises. Les antigènes protéine / glycoprotéine sont présentés par les voies du CMH de classe I ou du CMH de classe II menant aux cellules T menant à l'activation des cellules T. Cependant, des données récentes indiquent l’existence possible d’une troisième voie de présentation de l’antigène.
La troisième voie est suggérée pour présenter les lipides antigéniques et les glycolipides des mycobactéries. On pense que les molécules de la famille CD1 dans les APC présentent l'acide mycolique de Mycobacterium tuberculosis et le lipoarabinomannane de Mycobacterium leprae. Mais le mécanisme exact et les étapes impliquées dans la troisième voie de présentation de l'antigène ne sont pas connus.
Pertinence clinique
MHC and Disease Association :
De nombreuses études sur la famille et la population ont montré une association entre certaines molécules du CMH et certaines maladies. Le tableau 11.3 répertorie certaines des associations les plus significatives entre le CMH et les maladies. Comme le montre le tableau, de nombreuses maladies auto-immunes se produisent plus fréquemment chez les personnes portant certaines molécules du CMH. For example, in the US Caucasian population, a person having HLA-B27 molecule has 80 fold increased risk of developing a disease called ankylosing spondylitis, when compared to a person who doesn't have HLA-B27 molecule.
The significance of HLA and disease association is not known. Whether the particular HLA molecule is responsible for the development of disease or the particular HLA molecule is merely a marker of another gene (which may be primarily responsible for the disease) is not known.
The MHC and disease association is indicated as 'relative risk'. It is an odd ratio reflecting the relative frequency of each disease in individuals with a particular HLA marker compared with the frequency of the disease in individuals not carrying that marker.
The incidence of a disease in patients with a given HLA type is compared with the incidence of the disease in patients without this HLA type and expressed as relative risk. Relative risk is calculated by dividing the frequency of the HLA allele in the patient population by the frequency of the HLA allele in the given general population.
Relative risk = (HLA Ag + / HLA Ag + ) in disease population / (HLA Ag + / HLA Ag + ) in control population
Table 11.3: HLA and autoimmune disease association in Caucasoid:
Allèle HLA | Maladie auto-immune | Risque relatif |
DR2 | Sclérose en plaque | 4 |
DR2 | Le lupus érythémateux disséminé | 3, 5 |
DR3 | Spgren's syndrome | dix |
DR3 | Maladie coeliaque | 12 |
DR3 | Diabète sucré insulino-dépendant | 5 |
DR3 | Hépatite chronique active | 14 |
DR4 | La polyarthrite rhumatoïde | 6 |
DR4 | Pemphigus vulgaris | 24 |
B27 | Spondylarthrite ankylosante | 90 |
A relative risk of 1 implies that the HLA allele is expressed with the same frequency in the patient population as well as the control population and therefore the HLA allele doesn't confer any increased risk for the disease. But a higher relative risk value implies that the chances of association of the disease with this HLA allele is more; and consequently, a person with this HLA allele has more chance of developing the disease. (For example, the relative risk for the disease chronic active hepatitis and HLA DR3 is 14. That means an individual with HLA DR3 has 14 times more chance of developing chronic active hepahtis than those who lack HLA DR3 in the same population.)
Clinical Applications of HLA Typing:
1. HLA typing of the donor and recipient is an essential procedure before transplantation of an organ. HLA typing helps in the identification of a donor who has HLA antigens similar to the HLA antigens of recipient.
2. The clinical value of HLA typing for diagnosis is limited to HLA B27 and ankylosing spondylitis. Even here one should remember the possibilities of 10 percent false-positive and false-negative rates.
3. HLA studies may be of value in genetic counseling and early recognition of some diseases in families (eg idiopathic hemochromatosis or congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency).
4. Because of the high degree of polymorphism of HLA genes and their products, HLA typing is a powerful tool for paternal typing and other medicolegal applications. (Blood group antigens, HLA, serum proteins, red cell enzymes, and DNA polymorphisms of an individual are unique and may be used to determine the parentage. It is usually possible to exclude a falsely accused person; but these tests cannot prove that a particular man is the father of the child in question).
5. Anthropologic studies: Because certain red cell and HLA antigens are restricted to specific geographic areas, analysis of the frequencies of these antigens is of interest in studying the origin and migration of people of different races. Antigens such as HLA-B8 and HLA-Al are common in Caucasians of European origin, but absent in Orientals.